La pneumonie nosocomiale est l'infection nosocomiale la plus fréquente et la plus grave, dont 40 % sont des pneumonies acquises sous ventilation mécanique (PAVM). La PAVM causée par des agents pathogènes réfractaires reste un problème clinique complexe. Depuis des années, les recommandations préconisent diverses interventions (telles que la sédation ciblée et l'élévation de la tête) pour prévenir la PAVM. Cependant, la PAVM survient chez jusqu'à 40 % des patients intubés trachéalement, entraînant des hospitalisations plus longues, une augmentation du recours aux antibiotiques et des décès. La recherche de mesures préventives toujours plus efficaces est constante.
La pneumonie sous ventilation assistée (PAVA) est une pneumonie d'apparition récente qui se développe 48 heures après l'intubation trachéale. Il s'agit de l'infection nosocomiale la plus fréquente et la plus mortelle en unité de soins intensifs (USI). Les recommandations de 2016 de l'American Society of Infectious Diseases distinguent la PAVA de la pneumonie nosocomiale (PNA) (la PNA désigne uniquement la pneumonie survenant après une hospitalisation sans sonde trachéale et n'étant pas liée à la ventilation mécanique ; la PAVA désigne une pneumonie après intubation trachéale et ventilation mécanique). La Société européenne et la Chine estiment que la PAVA reste un type particulier de PNA [1-3].
Français Chez les patients sous ventilation mécanique, l'incidence de la PAVM varie de 9 % à 27 %, le taux de mortalité est estimé à 13 %, et elle peut entraîner une augmentation de l'utilisation d'antibiotiques systémiques, une ventilation mécanique prolongée, un séjour prolongé en USI et une augmentation des coûts [4-6]. La PAN/PAVM chez les patients non immunodéprimés est généralement causée par une infection bactérienne, et la distribution des agents pathogènes courants et leurs caractéristiques de résistance varient selon la région, la classe d'hôpital, la population de patients et l'exposition aux antibiotiques, et évoluent au fil du temps. Pseudomonas aeruginosa dominait les agents pathogènes liés à la PAVM en Europe et en Amérique, tandis que davantage d'Acinetobacter baumannii ont été isolés dans les hôpitaux tertiaires en Chine. Un tiers à la moitié de tous les décès liés à la PAVM sont directement causés par l'infection, le taux de mortalité des cas causés par Pseudomonas aeruginosa et acinetobacter étant plus élevé [7,8].
En raison de la forte hétérogénéité de la PAVM, la spécificité diagnostique de ses manifestations cliniques, de l'imagerie et des examens de laboratoire est faible, et l'éventail des diagnostics différentiels est large, ce qui rend difficile le diagnostic précoce de la PAVM. Parallèlement, la résistance bactérienne pose un sérieux défi au traitement de la PAVM. On estime que le risque de développer une PAVM est de 3 %/jour pendant les 5 premiers jours d'utilisation de la ventilation mécanique, de 2 %/jour entre 5 et 10 jours, et de 1 %/jour le reste du temps. Le pic d'incidence survient généralement après 7 jours de ventilation, ce qui constitue une fenêtre d'opportunité pour prévenir l'infection précocement [9,10]. De nombreuses études ont examiné la prévention de la PAVM, mais malgré des décennies de recherche et de tentatives pour la prévenir (comme éviter l'intubation, prévenir la réintubation, réduire la sédation, surélever la tête du lit de 30° à 45° et prendre soin de la bouche), l'incidence ne semble pas avoir diminué et la charge médicale associée reste très élevée.
Les antibiotiques inhalés sont utilisés pour traiter les infections chroniques des voies respiratoires depuis les années 1940. Leur capacité à optimiser l'administration des médicaments au site cible de l'infection (c'est-à-dire les voies respiratoires) et à réduire les effets secondaires systémiques a démontré leur intérêt dans diverses pathologies. Leur utilisation dans la mucoviscidose est désormais approuvée par la Food and Drug Administration (FDA) américaine et l'Agence européenne des médicaments (EMA). Ils peuvent réduire significativement la charge bactérienne et la fréquence des exacerbations des bronchectasies sans augmenter le nombre total d'événements indésirables. Les recommandations actuelles les reconnaissent comme traitement de première intention pour les patients atteints d'une infection à Pseudomonas aeruginosa et présentant des exacerbations fréquentes. Les antibiotiques inhalés peuvent également être utilisés comme adjuvants ou prophylactiques pendant la période périopératoire d'une transplantation pulmonaire [11,12]. Cependant, dans les recommandations américaines de 2016 sur la VAP, les experts doutaient de l'efficacité des antibiotiques inhalés adjuvants en raison de l'absence d'essais contrôlés randomisés de grande envergure. L'essai de phase 3 (INHALE) publié en 2020 n'a pas non plus réussi à obtenir de résultats positifs (antibiotiques intraveineux assistés par inhalation d'amikacine pour l'infection bactérienne à Gram négatif causée par les patients atteints de VAP, un essai d'efficacité de phase 3 en double aveugle, randomisé, contrôlé par placebo, un total de 807 patients, médicament systémique + inhalation assistée d'amikacine pendant 10 jours).
Dans ce contexte, une équipe dirigée par des chercheurs du Centre hospitalier universitaire régional de Tours (CHRU) en France a adopté une stratégie de recherche différente et a mené un essai d'efficacité contrôlé randomisé, multicentrique, en double aveugle et initié par l'investigateur (AMIKINHAL). L'amikacine inhalée ou un placebo pour la prévention des PAVM ont été comparés dans 19 USI en France [13].
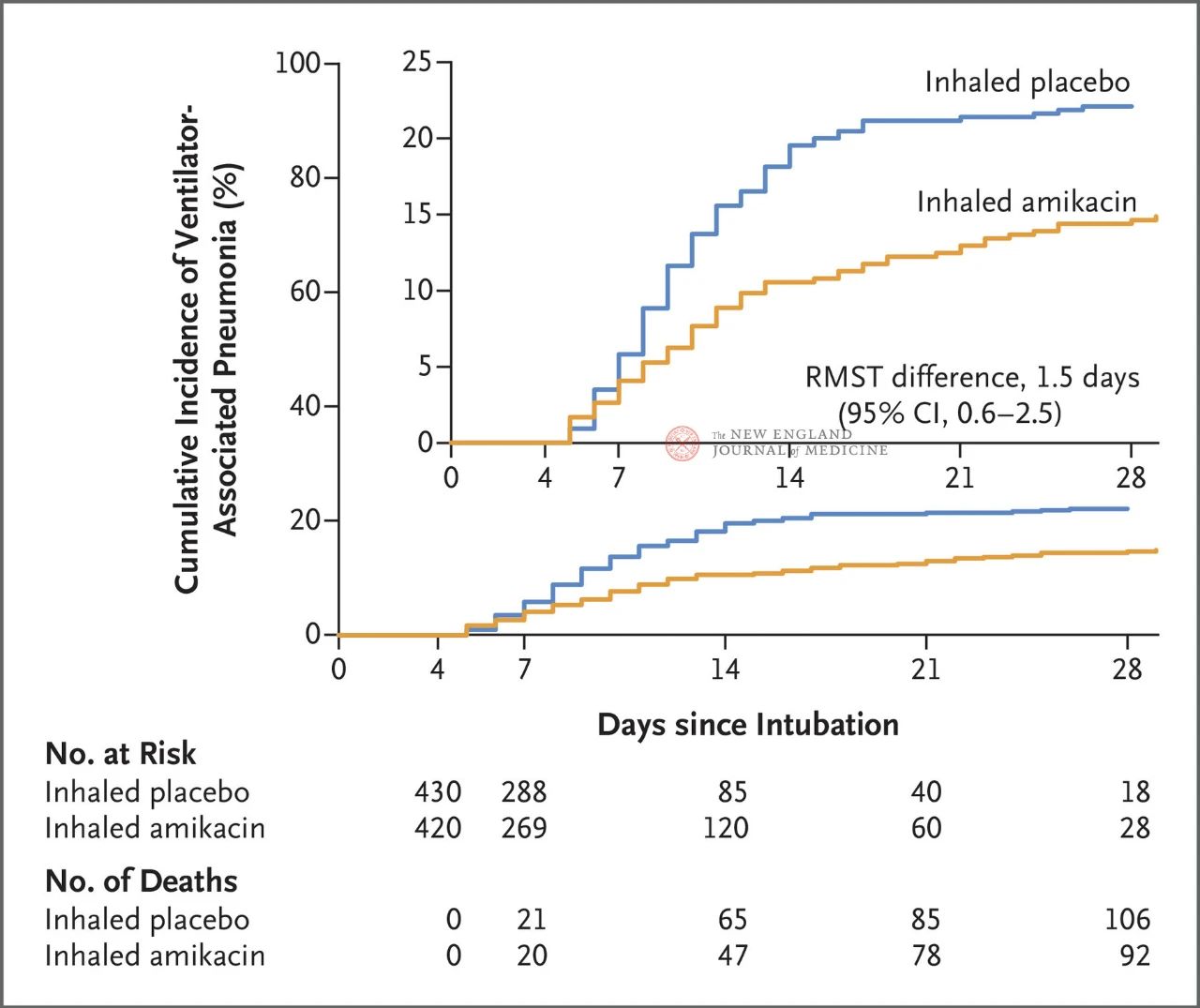
Au total, 847 patients adultes sous ventilation mécanique invasive entre 72 et 96 heures ont été randomisés selon un rapport 1:1 pour recevoir de l'amikacine par inhalation (N = 417, 20 mg/kg de poids corporel idéal, une fois par jour) ou un placebo par inhalation (N = 430, équivalent chlorure de sodium à 0,9 %) pendant 3 jours. Le critère d'évaluation principal était le premier épisode de PAVM entre le début de la randomisation et le 28e jour.
Les résultats de l'essai ont montré qu'à 28 jours, 62 patients (15 %) du groupe amikacine avaient développé une PAVM et 95 patients (22 %) du groupe placebo avaient développé une PAVM (la différence de survie moyenne limitée pour la PAVM était de 1,5 jour ; IC à 95 %, 0,6~2,5 ; P = 0,004).
En termes de sécurité, sept patients (1,7 %) du groupe amikacine et quatre patients (0,9 %) du groupe placebo ont présenté des effets indésirables graves liés à l'essai. Parmi les patients qui ne présentaient pas d'insuffisance rénale aiguë au moment de la randomisation, 11 patients (4 %) du groupe amikacine et 24 patients (8 %) du groupe placebo présentaient une insuffisance rénale aiguë au jour 28 (HR : 0,47 ; IC à 95 % : 0,23-0,96).
L'essai clinique a présenté trois points forts. Premièrement, en termes de conception, l'essai AMIKINHAL s'appuie sur l'essai IASIS (un essai de phase II parallèle, randomisé, en double aveugle, contrôlé par placebo, portant sur 143 patients). Afin d'évaluer la sécurité et l'efficacité de l'inhalation d'amikacine-fosfomycine pour le traitement systémique des infections bactériennes à Gram négatif causées par la PAVM, et sur l'essai INHALE, dont les résultats ont été négatifs, l'étude s'est concentrée sur la prévention de la PAVM et a obtenu des résultats relativement satisfaisants. Compte tenu de la mortalité élevée et de la durée d'hospitalisation prolongée chez les patients sous ventilation mécanique et souffrant de PAVM, si l'inhalation d'amikacine permet d'obtenir des résultats significativement différents en termes de réduction de la mortalité et de la durée d'hospitalisation chez ces patients, elle sera plus utile pour la pratique clinique. Cependant, compte tenu de l'hétérogénéité des traitements et des soins tardifs chez chaque patient et chaque centre, plusieurs facteurs de confusion peuvent interférer avec l'étude ; il pourrait donc être difficile d'obtenir un résultat positif attribuable aux antibiotiques inhalés. Par conséquent, une étude clinique réussie nécessite non seulement une excellente conception de l’étude, mais également la sélection de critères d’évaluation principaux appropriés.
Deuxièmement, bien que les antibiotiques aminosides ne soient pas recommandés comme médicament unique dans diverses recommandations pour la PAVM, ils peuvent être utilisés contre les agents pathogènes courants chez les patients atteints de PAVM (notamment Pseudomonas aeruginosa, Acinetobacter, etc.), en raison de leur absorption limitée dans les cellules épithéliales pulmonaires, de leur forte concentration au site d'infection et de leur faible toxicité systémique. Les antibiotiques aminosides sont largement privilégiés parmi les antibiotiques inhalés. Cet article concorde avec l'estimation exhaustive de l'ampleur de l'effet de l'administration intratrachéale de gentamicine sur de petits échantillons, publiée précédemment, qui démontre conjointement l'effet des antibiotiques aminosides inhalés dans la prévention de la PAVM. Il convient également de noter que la plupart des placebos sélectionnés dans les essais portant sur les antibiotiques inhalés sont des sérums salés normaux. Cependant, étant donné que l'inhalation atomisée de sérum salé normal peut jouer un rôle dans la dilution des expectorations et favoriser l'expectoration, le sérum salé normal peut entraîner certaines interférences dans l'analyse des résultats de l'étude, ce qui doit être pris en compte de manière exhaustive dans l'étude.
De plus, l'adaptation locale du traitement des HAP/VAP est importante, tout comme l'antibioprophylaxie. Par ailleurs, quelle que soit la durée d'intubation, l'environnement des unités de soins intensifs locales constitue le principal facteur de risque d'infection par des bactéries multirésistantes. Par conséquent, le traitement empirique doit se référer autant que possible aux données microbiologiques des hôpitaux locaux et ne peut se fier aveuglément aux recommandations ou à l'expérience des hôpitaux tertiaires. Par ailleurs, les patients gravement malades nécessitant une ventilation mécanique présentent souvent des pathologies multisystémiques et, sous l'action combinée de multiples facteurs tels que le stress, un phénomène de transmission croisée des microbes intestinaux aux poumons peut également se produire. La forte hétérogénéité des maladies, due à la superposition interne et externe, indique également que la promotion clinique à grande échelle de chaque nouvelle intervention est loin d'être achevée.
Date de publication : 02/12/2023